다케다 P-CAB계열 소아기관질환 치료제 보노프라잔의 미란성 식도염 단독요법에 대한 FDA 승인이 거부됐다.
다케다로부터 북미지역 판권을 확보, 상업화를 진행하는 패톤(Phathom) 파마슈티컬스는 9일 FDA로 부터 미란성 식도염에 대한 승인신청 관련 완결된 응답서신(CRL)을 접수받았다고 밝혔다. 불순물인 니트로사민 검출이 문제가 됐다.
당초 승인 목표예정은 1월 11일. 직전에 패톤은 승인검토 일정연기를 통보받은 지 한달 만에 완결된 응답서신을 접수 받게됐다. 이에 따라 패톤 측은 불순물 관련 안전성 자료 등을 보완, 재승인 신청의 과정을 다시 거쳐야 한다.
패톤사는 "서한에서 니트로사민의 불순물 수준을 일일 허용섭취량 이하(FDA 협의 한도용량 일일 96ng)로 유지된다는 점을 입증할 안전성 데이터를 요구했으며, 추가적인 결함이 언급되지 않았다"고 설명했다.
이어 "니트로사민의 허용 가능한 섭취량 이하로 관리하기 위한 조치를 마무리한 만큼 1분기 이내 승인 재신청에 대해 FDA와 논의할 수 있기를 희망한다"고 밝혔다.
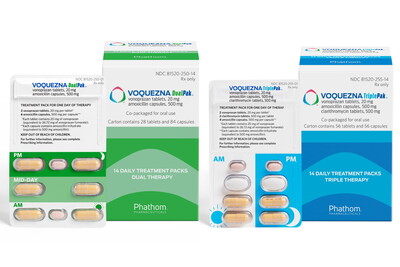
보노프라잔은 앞서 지난해 5월 아목시실린과 클라리스로마이스 등과 병용요법으로 헬리코박터 파이로리(H. pylori) 균 치료제로 FDA 승인을 받았었다.
상품명은 보퀘즈나(Voquezna) 트리풀팩과 듀얼팩. 제품 출시이후 보노프라잔에서 불순물 검출이 확인돼, 해당 2,3제 요법의 상업화 중단 및 출시 지연과 미란성 식도염에 대한 단독요법 승인에 차질이 발생했다.
국내에서는 다케다가 상품명 보신티로 2019년 시판 허가를 받았다. 승인 적응증은 위궤양, 미란성 위식도역류질환 치료와 유지요법, NSAIDs 투약 시 위궤양 또는 십이지장궤양 재발 방지 등이다.
같은 계열의 경쟁약물은 에이치케이이노앤의 케이캡, 대웅제약 펙스클루 등이 있다.



